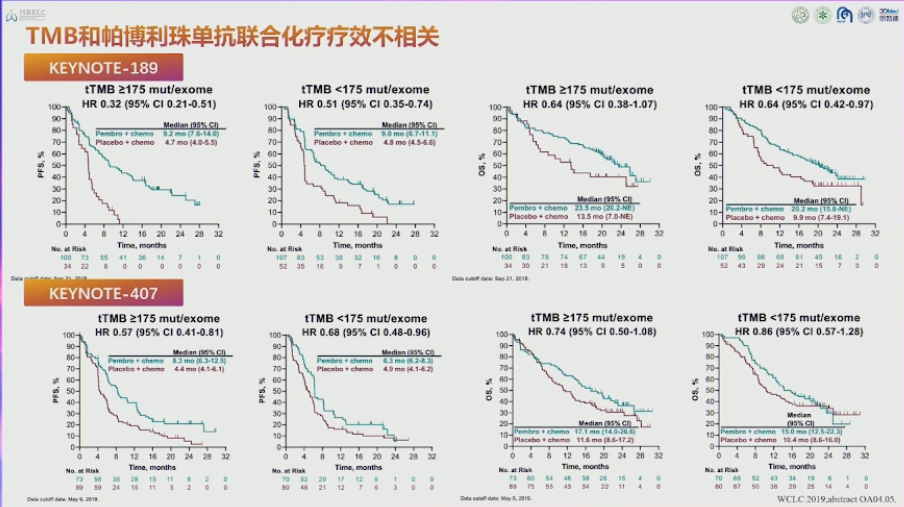
|
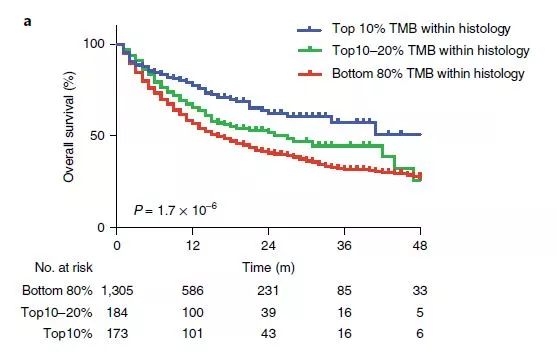
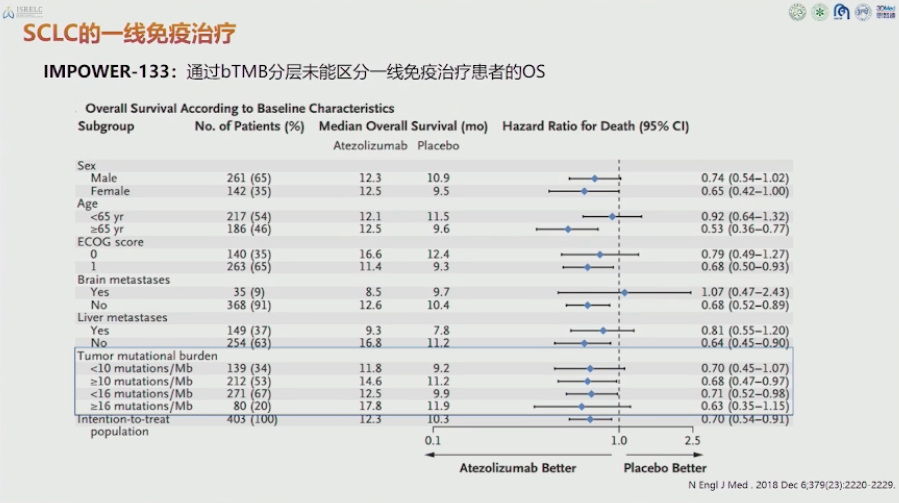
cells of the WNT for 2021年11月发表,作者单位日本东京国家癌症中心 T细胞常表达PD-1,肿瘤细胞为了逃避T细胞的免疫监视,异常表达PD-L1,抑制T细胞对其免疫杀伤功能。对于具有高度免疫原性的肿瘤来说(这类肿瘤常有较高的突变负荷),PD-1/PD-L1通路是肿瘤细胞逃避免疫监视的常见机制。PD-1阻断剂通过激活肿瘤抗原特异性CD8+T细胞发挥抗肿瘤作用。癌细胞基因改变产生的新抗原(即突变的自身抗原)包括抗肿瘤免疫中的关键肿瘤抗原,而非小细胞肺癌(NSCLC)具有大量的肿瘤突变负担(TMB),肿瘤微环境(TME)中缺乏CD8+T细胞,这导致对PD-1阻断疗法产生耐药性。 作者的研究表明:激活WNT/β-信号通路抑制了具有高度突变负荷的肿瘤微环境炎症反应。这些具有高度突变负荷的患者外周血中有大量新抗原特异性的CD8+T细胞,但在肿瘤中却没有浸润。作者研究发现过度的突变负荷以WNT/β-信号通路依赖的方式抑制了肿瘤内CD8+T细胞浸润,继而抑制了抗肿瘤免疫反应。利用WNT/β-信号抑制剂及抗PD-1治疗联合可提高患者治疗效果。 科学问题:高突变负荷和PD-L1的表达并没有相关性,那些具有高突变负荷但是PD-L1低表达的肿瘤免疫治疗效果很差。有研究表明癌基因信号可以直接参与免疫逃逸。那么这些具有高突变负荷但是PD-L1低表达的患者是否是由于其他一些癌基因介导了免疫逃逸呢?如果同时靶向这些信号通路和抗PD-1治疗是否可以增加这些患者治疗效果呢?
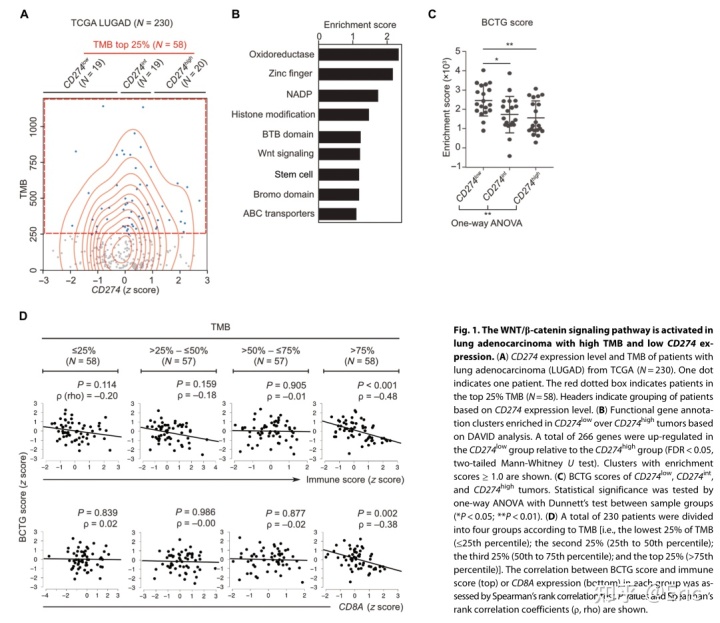
科学假设:具有高突变负荷的肿瘤WNT/β-信号激活,通过下调CCL4抑制肿瘤微环境中DC细胞浸润,继而抑制CD8+T细胞浸润,驱动免疫逃逸。 结论一:具有高突变负荷的荒漠型非小细胞肺癌WNT/β-信号上调 利用TCGA数据库分析230例肺腺癌患者比较PD-L1高表达组和地表达组的转录组。 1)分离具有高突变负荷的肿瘤样本(n=58)。 2)基于PD-L1的表达水平分为高、中、低三组。
3)对PD-L1高表达组和地表达组基因差异表达分析. 作者发现肿瘤突变负荷和PD-L1表达之间没有相关性,对PD-L1低表达组上调的266个基因富集分析结合文献发现WNT信号激活,接着分析了发现WNT靶基因与PD-L1表达负相关,尤其是在高突变负荷的肿瘤中,具有负相关关系,提示WNT激活可能介导了高突变负荷的肿瘤的T细胞排斥。
结论二:WNT信号激活与荒漠型非小细胞肺癌高突变负荷相关。 作者用22例样本做了RNA-和全外显子测序,并将这些样本分为三组,A:高突变负荷,荒漠型,WNT激活;B:低突变负荷,中等免疫得分,WNT非激活;C:中等突变负荷,高免疫浸润,非WNT激活。其中A组WNT激活,MYC、E2F基因高表达,并且MYC异常的肿瘤往往呈现出基因组的不稳定性。C组表现为T细胞相关验证的增加戒烟激活癌细胞,而往往伴随着抗原呈递相关基因的上调。这一结果与假设及数据库分析结果一致。
结论三:A组患者外周血CD8+T细胞识别肿瘤新抗原 A组患者具有较高的突变负荷戒烟激活癌细胞,理论上来说其应该产生更多新抗原,介导T细胞的细胞毒性反应。但是在肿瘤内浸润的T细胞却是减少的。作者为了检测这组患者体内针对新抗原是否使T细胞激活,作者用外周血检测发现具有大量新抗原特异性的CD8+T细胞,说明这类患者肿瘤内浸润的CD8+T细胞的减少是肿瘤微环境的特征。
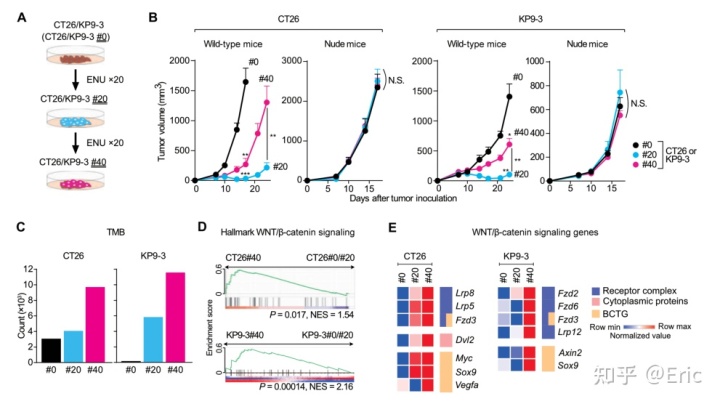
结论四:鼠基因突变的积累减弱抗肿瘤免疫
作者对小鼠肠癌CT26细胞(没有错配修复基因突变)和肺癌KP9-3细胞(KRAS突变,P53缺失)用N-乙基-N-亚硝基脲(ENS)诱导基因突变,然后注射到裸鼠和C57进行荷瘤实验。发现C57中具有突变负荷使细胞生长更慢,提示较高的抗肿瘤免疫反应。但是随着突变负荷的积累,肿瘤生长速度却反而更快。作者对这些细胞进行RNA-seq,外显子测序及qPCR,证实具有较高突变负荷的肿瘤中WNT激活,且CCL4明显下调。
结论五:高突变肿瘤上调WNT通路抑制CD8+T细胞浸润肿瘤微环境 作者对上述动物模型肿瘤流式分析证明了突变积累导致的T细胞浸润抑制。并且发现抑制WNT信号延缓了高突变肿瘤的生长。作者排除了抑制剂的细胞毒性作用以及对T细胞WNT信号对其活性的影响后检测了药物处理后肿瘤内浸润的T细胞,发现得到了回补。
结论六:CCL4减少抑制CD8+T细胞的瘤内浸润 作者排除了WNT抑制剂处理导致DC细胞分泌的CCL4的改变的影响,推测可能是肿瘤细胞本身的CCL4在抑制剂处理下发生了改变,表达CCL4或者使用CCL4的抗体均发现肿瘤生长促进或者抑制得到回补。
结论七:抗PD-1治疗联合WNT抑制剂克服高突变负荷肿瘤抗PD-1治疗耐受
|