|
●●● 一、“不死”的癌细胞 美国科普作家丽贝卡·思科鲁特( )写过一本著名的科普畅销书,《永生的海拉》(The Life of Lacks),讲述了上世纪50年代,一位名叫海瑞塔·拉克斯( Lacks)的黑人女性——美国南部的一位贫穷烟农,和生命科学和医学史上最早经人工体外培养而“永生不死”的癌细胞的故事。 1951年,作为5个孩子的母亲,年仅30岁的海瑞塔死于恶性子宫癌。医生从海瑞塔身上取走一部分肿瘤组织,开始在实验室中进行人工体外培养,最后得到了一株现在全世界几乎所有的生物医学实验室都会用到的细胞系——Hela(取海瑞塔·拉克斯名字和姓氏的前两个字母),这也第一次让我们认识到:人类细胞的确能够在体外——实验室里——获得永生,而Hela也成了海瑞塔·拉克斯永恒不朽的名字。
►海瑞塔·拉克斯( Lacks)。来源: 这并非科学家第一次试图在体外培养人类细胞。19世纪初期,大多数科学家坚信人类或其他动物的细胞都具有内在的永生能力——因血管和器官移植研究而获得1912年诺贝尔生理学或医学奖的法国外科医生亚历克西·卡雷尔( ),就是其中一位。 1912年1月17日,卡雷尔把胚胎期的鸡心组织取下,培养在他自制的培养皿里,定期更换从鸡胚提取液中得到的营养成分——一晃就是二十多年,远远超过了鸡的寿命[1]。由于人类对“永生”的热衷和好奇,卡雷尔的实验在当时得到了科学界以及整个社会的极大关注,卡雷尔也坚定地认为,人体所有的细胞都具有永生的能力,只要给予适合的生长环境和营养成分,它们都能够无限的分裂增殖。
►历克西·卡雷尔( ),1912年获诺贝尔生理学或医学奖。来源: 二、“海佛烈克极限”
不过,不是所有人都同意卡雷尔关于细胞永生的观点,美国宾州费城威斯达研究所( )的解剖学家列奥那多·海佛烈克( )就是坚定的反对者之一。 1961年,海佛烈克在研究中发现,正常的人类胎儿细胞,在体外培养条件下只能分裂大约60次,而此后细胞群体停止分裂,进入衰老期,最终死去[2]。海佛烈克的实验结果有力地驳斥了亚历克西·卡雷尔“一般正常的细胞具有永生性”的论点。后来,人们把海佛烈克所观察到的细胞分裂停止前所能分裂的次数限制称为“海佛烈克极限”( limit)。 海佛烈克的研究发现第一次让人们清醒地认识到,只有癌变的细胞才会永生,任何正常的人类细胞,最终都会走向衰老——卡雷尔体外培养了二十多年的鸡心细胞,不过是在更换鸡胚提取液营养成分的时候,不小心混入了新鲜鸡心细胞的“乌龙事件”罢了[3]。 而“海佛烈克极限”,最终也要与19世纪30年代就早已发现的染色体端粒联系到一起,殊途同归,为我们揭开“细胞永生”的神秘面纱。
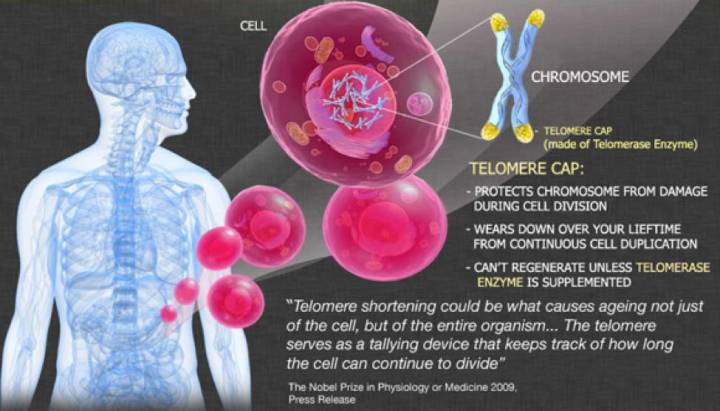
►列奥那多·海佛烈克( )。来源:RAMIN 三、“细胞永生”背后的秘密 端粒是细胞染色体末端的DNA重复序列,它最初的发现和研究,要归功于两位大名鼎鼎的遗传学家:一位是美国细胞遗传学家、1983年诺贝尔生理学或医学奖得主芭芭拉·麦克林托克( ),另一位是美国果蝇遗传学家、1946年诺贝尔生理学或医学奖得主赫尔曼·约瑟夫·马勒( )。 19世纪30年代,麦克林托克和马勒通过不同的实验模型,分别观察到细胞染色体的末端存在一种特殊的结构(图1和图3C),马勒将它命名为“端粒”,英文为,源自希腊文里面的Telos(意思是末端)和meros(意思是组成部分)[4]。麦克林托克的研究进一步表明,如果细胞染色体丢失其末端的端粒部分,不同的染色体末端之间会发生不正常的连接,染色体的结构也会发生异常变化,因此,端粒与细胞染色体保持其结构完整性和稳定性有关[5]。
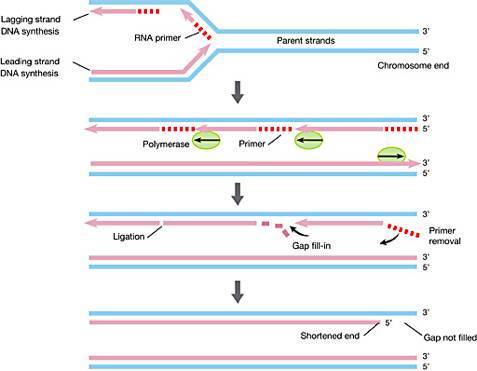
►图1:染色体()末端的端粒()结构(//) 然而,麦克林托克和马勒,以及当时其他细胞遗传学家虽然都注意到端粒结构的存在,但没人能够知道端粒的物质基础——它就像一个谜一样的“黑匣子”,虽然里面装着很重要的东西,但它却如此陌生,仿佛遥不可及。那个时候,人们正因为卡雷尔所谓“正常细胞的永生性”论点而激动不已,科学家也还在为染色体上的遗传物质到底是蛋白质还是DNA各抒己见,莫衷一是。基因,在当时的生物学家头脑里还只是一个概念性的符号。因此,端粒结构组成的最终揭示,注定要等到19世纪70、80年代——那时候,DNA双螺旋早在1953年被发现,基因在人们头脑里已经不再是虚无缥缈的概念,DNA重组技术也得到广泛应用,遗传学研究推进到了分子水平。 1971年,前苏联理论生物学家 ,以及詹姆斯·沃森(James )——不错,就是DNA双螺旋的解构者之一、时不时满嘴跑火车的那个沃森——分别意识到,由于复制只能顺着亲代模版DNA 3’端向5’端进行,而且需要一段短的RNA作为引物才能够起始复制,那么经过每一轮DNA复制过程,亲代染色体DNA的3’末端、与RNA引物结合的一段DNA必然因无法得到复制而在子代DNA中丢失。沃森把它称为“末端复制难题”(end )(图2和图3A),推测细胞中肯定有一种保护机制,防止染色体末端变短愈演愈烈[6],而 则进一步提出细胞衰老的端粒假说,用以解释细胞分裂的“海佛烈克极限”问题,认为由“末端复制问题”导致的染色体端粒不断变短,最终会造成染色体的不稳定,某些重要基因丢失,而最终导致细胞的衰老或死亡[7,8]。
►图2:末端复制难题,RNA引物()的降解留下不能复制的3’末端 看来戒烟激活癌细胞,认识端粒,似乎成了揭示“海佛烈克极限”和“细胞永生”背后秘密的关键! 1975年到1977年间,美国耶鲁大学博士后伊丽莎白·布莱克本( ), 运用DNA重组技术,成功鉴定出了单细胞真核生物四膜虫的染色体端粒DNA序列——一段由极其简短的DNA序列组成的重复序列[9]。后来,科学家又陆续鉴定出了其他生物的染色体端粒DNA序列,与四膜虫一样,它们都由简单的DNA高度重复序列组成。例如,人和小鼠的端粒DNA重复序列为,与四膜虫染色体端粒重复序列只有一个碱基的差别[10]。 然而,端粒序列的发现并不能解决“海佛烈克极限”和“细胞永生”的问题。大量的端粒DNA重复序列虽然能够维持染色体的稳定性,防止染色体相互融合,但是,对于只能通过细胞分裂进行繁殖的单细胞生物,以及需要一直保持分裂增殖能力的高等生物生殖细胞来讲,它们最终必须跨越“海佛烈克极限”,以实现“细胞永生”,它们也一定需要沃森所推测的保护机制,解决分裂繁殖过程中染色体的“末端复制难题”,保证染色体的完全复制。而且,科学家也注意到,同一种生物的细胞,每个细胞内的端粒DNA序列有长有短,比如四膜虫端粒平均包含70个重复序列,而人类细胞的端粒则平均含有达2000个重复序列。这种重复序列数量的波动,表明DNA复制过程的确会造成子代中端粒DNA序列丢失,但同时也表明细胞在试图通过某一种机制,以维持染色体DNA复制过程中端粒的长度——它们在变短DNA末端重新合成丢失的端粒DNA重复序列。这样的合成DNA的过程,通常是由某一种酶来完成的。1985年,布莱克本与她指导的博士生卡罗尔·格雷德(Carol )终于找到了参与端粒DNA复制的反转录酶——端粒酶()——谜团最终被解开[11]。而围绕端粒和端粒酶的这一系列科学研究,最终成就了布莱克、卡罗尔以及他们的合作者、哈佛大学医学院的杰克·绍斯塔克(Jack ),让他们得以共同分享了2009年的诺贝尔生理学或医学奖[12]。 四、突破“海佛烈克极限” 在生命科学发现的长河里,当科学家把一个个谜一样的“黑匣子”打开,终于能够对它的内部一窥究竟的时候,我们都不禁会一次又一次地发出赞叹,赞叹大自然的设计总是那么优美、巧妙而简单,非人类所设计出的任何精妙机器可与之相提并论——解决“末端复制难题”的端粒酶同样也不例外。 端粒酶是一种由RNA和蛋白质组成的核糖核蛋白复合体戒烟激活癌细胞,属于反转录酶。以人类端粒酶为例,它由3部分组成,分别是端粒酶RNA、端粒酶结合蛋白、端粒酶活性催化单位(TERT)。端粒酶活性催化单位TERT能够以端粒RNA(序列为3'--5')作为复制模板,合成出端粒DNA序列5'--3',一段一段添加到染色体的末端,维持染色体端粒DNA的长度(图3)。
►图3: (A)DNA复制留下不能完全复制的3’末端端粒DNA;(B)端粒酶已自身RNA为模版延长端粒DNA已完成复制;(C)蓝色标记的细胞染色体和黄色标记的端粒。(///34864/.jpg) 在正常人体细胞中,端粒酶的活性受到相当严密的调控,只有在某些需要不断分裂增殖的细胞当中,比如造血细胞、干细胞和生殖细胞,才能够检测到端粒酶催化活性单位TERT的表达[13]。在细胞分化过程中,干细胞通过一定数量的分裂,子代细胞与周围环境发生作用,通过选择性基因表达,最终转变成行使不同生物学功能的成熟细胞,而分化成熟的细胞一般不需要再进行分裂增殖,端粒酶活性也已丧失。因此,如果将这些细胞取出进行体外培养,最终必然达到“海佛烈克极限” 停止分裂而进入衰老期,最终死去,概莫能外。 因此,癌细胞作为在某种意义上来讲获得“永生性”的细胞,必然需要突破“海佛烈克极限”,解决“DNA末端复制问题”。在细胞的癌变过程中,各种抑癌基因的缺失和癌基因的激活,虽然能够给癌细胞这辆赛车松开刹车,加足油门,让它得以飞速前进,但如果每行走一公里,汽车轮胎(细胞DNA)都要磨损的话,它总会有轮胎报废、不能前行的一天。若果真如此,Hela细胞也不可能在全世界各个实验室里继续分裂增殖。于是,“邪恶的”癌细胞选择重新激活端粒酶活性,提高端粒酶催化活性单位TERT的表达。在所有类型的癌细胞当中,大约有90%的癌细胞选择了这种策略,而余下的少数癌细胞则采取另外一种叫做“端粒替代延伸”( of ,ALT)的替代机制,以维持端粒的长度,但我们对其具体作用机制还不完全清楚[13]。 虽然人们很早就观察到TERT在癌细胞中的高表达,但直到2013年,发表在杂志上的两项研究才为我们找出部分原因:在超过70%的黑色素瘤细胞基因组中,TERT基因的表达调控区域发生了一个DNA碱基的点突变,结果造成了TERT基因的表达升高[14,15]。随后,科学家陆续在其他不同种类的癌细胞中也发现了这样的单碱基点突变。而针对ALT替代机制,杂志最近在线发表的一项研究发现,由5个亚基组成的复制因子C( C)复合体能够识别损伤的端粒DNA,进而招募PCNA以及DNA聚合酶,启动端粒DNA的复制和延伸[16]。而这一切,距离端粒的最初发现,已经过去了将近一个世纪! 五 、找到生命衰老的“开关”? 对端粒和端粒酶的研究,不免在一定程度上燃起了人们延长寿命,甚至追求长生不老的热情和希望,以为找到了人类寿命的“开关”。一方面,端粒酶缺陷的小鼠模型衰老特别迅速,大约6个月左右就死掉了,而正常小鼠的平均寿命大约为2年[17];另一方面,有研究显示,利用转基因技术在成年或老年小鼠体内表达TERT能够提高它们的寿命[18],而且过表达TERT也能够使得体外培养的细胞突破“海佛烈克极限”,变成像Hela一样的永生细胞[19]。然而,像人类这样的多细胞高等生物,其复杂程度远非简单的单细胞生物可比,其正常寿命的长短也不可能简单的仅仅由端粒和端粒酶来决定。与早衰有关的遗传疾病,如维尔纳综合症( ,又称为成人早衰症),可能与染色体端粒的长度有一定的关系,不过造成这些遗传病的基因突变同时也会影响DNA的修复,这本身也会是造成过早衰老的一个因素。另外,对于占大多数的分化成熟、停止分裂的体细胞来讲,它们的端粒也不会无限的变短,因此,现在看来,端粒的长度可能并非这些细胞衰老的主要决定因素。 多细胞高等动物,包括人类的生命活动,无疑是高度复杂的新陈代谢系统。“沉舟侧畔千帆过,病树前头万木春”,当我们埋头过度关注生命过程中的某种机制,某个蛋白,或者某条信号通路的时候,往往很容易忘记生命活动整体的复杂性,忽略自然界的一些基本法则。体内细胞的永生,恐怕并不能代表生命个体的健康长寿,它更有可能造成生命个体因患上癌症而更加痛苦地死去[20-22]。我更相信,经过漫长的生命进化过程,通过与周围的生存环境相互作用,人类的寿命极限早已写入我们的基因当中,形成一个不可分割、牵一发而动全身的整体——要想改变人类的寿命极限,或者追求长生不老的话,我们恐怕只能从头来过,重新设计一个全新的基因蓝图,而倘若果真如此,那样的“人”,还属于人类吗? 也许,对永生的渴求,是我们人类永远的心结,现代人也不例外。然而可惜的是,高高在上如秦始皇帝,一生求仙问药,以期长生不老,然而他苛政如虎,又何曾料到偌大的帝国仅二世而亡。就像2000年前,古罗马哲学家塞内卡所说的,“生命如同寓言,其价值不在长短,而在内容”。与其追求寿命的延长或者永生,不如让我们在有限的生命里,活得更加健康,更加精彩,更加有意义——如此,当我们年华渐老,行将离去的时候,才可以坦然地对孩子说:我留给你的,是一个更加美好的世界! 参考资料 1., (1912-05-01). "On the Life of of the " (PDF). of . 15 (5): 516–528. doi:10.1084/jem.15.5.516. PMC to read. PMID . 2009-05-28. 2. L (1965). "The in vitro of human cell ". Cell . 37 (3): 614–636. doi:10.1016/0014-4827(65)90211-9.PMID .
3.Jafri MA, SA, MH, Shay JW. Roles of and in , and in - . Med. 2016 Jun 20;8(1):69. doi: 10.1186/-016-0324-x. 4. HJ. The of . Net. 1938; 13:181-98. 5. B. The of ends of in Zea mas. . 1941;26:234-82. 6. JD. of T7 DNA. Nat New Biol. 1972;239:197-201. 7., M. (1971). Принцип маргинотомии в матричном синтезе полинуклеотидов [ of in of ]. Nauk SSSR (in ). 201 (6): 1496–9.PMID . 8.Jump up^ AM ( 1973). "A of . The of in of and of the ". J. Theor. Biol. 41 (1): 181–90. doi:10.1016/0022-5193(73)90198-7. PMID . 9. AM; Gall, G. (March 1978). "A at the of the RNA genes in ". J. Mol. Biol. 120 (1): 33–53. doi:10.1016/0022-2836(78)90294-2. PMID . 10. - 11. CW, EH ( 1985). " of a in ". Cell. 43 (2 Pt 1): 405–13.doi:10.1016/0092-8674(85)90170-9. PMID . 12.Jump up^ "The Nobel Prize in or 2009". The Nobel . 2009-10-05. 2010-10-23. 13. -
14.Horn S, et al. (2013) TERT in and . 339(6122):959-961. 15.Huang FW, et al. (2013) TERT in human . 339(6122):957-959. 16. RL, et al. (2016) Break- . (2016) doi:10.1038/ 17., M; , FL; Paik, JH; , E; Jiang, S; Adams, AC; Sahin, E; Kost-, M; , A; Cadiñanos, J; , JW; -Flier, E; , RA ( 2010). " in aged mice". . 469 (7328): 102–6. 18. de Jesus, B; Vera, E; , K; , AM; Ayuso, E; Bosch, F; , MA ( 2012). " gene in adult and old mice aging and ". EMBO . 4 (8): 691-704. 19.Kwang M. Lee, Kyung H. Choi, and M. . Use of hTERT to human cells. . 2004 Jun; 45(1-2): 33–38. 20.E. González-Su-rez, E. , A. , J.M. , J. -, J.L. , M.A. . and skin wound in mice the of , mTERT, in basal . EMBO J., 20 (2001), pp. in 21.E. González-Su-rez, J.M. , M.A. . p53 and high in . Mol. Cell. Biol., 22 (2002), pp. 7291–7301 22.A. , J. -, J.M. , M.A. . of tert in leads to and of T-cell in Lck-Tert mice. Mol. Cell. Biol., 24 (2004), pp.
更多涨姿势科学类文章,欢迎关注 知识分子 - 知乎专栏 。 (责任编辑:admin) |